Agência reguladora americana conclui que remédio de R$ 17 milhões não causou morte de menino de 8 anos no Brasil
Com resultado, FDA recomendou a remoção da suspensão voluntária do uso do Elevidys
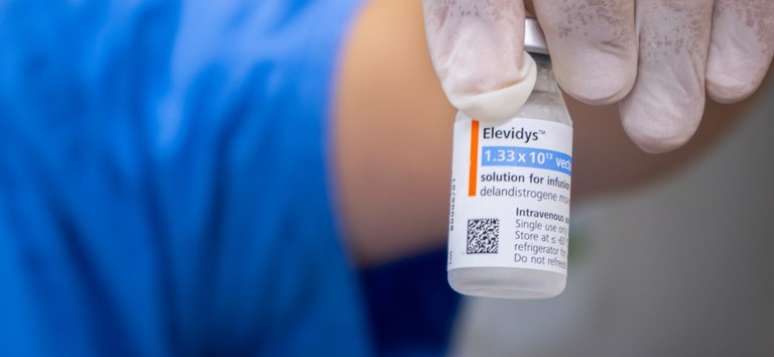
A Food and Drug Administration (FDA), agência reguladora dos Estados Unidos, informou que a morte de um menino de 8 anos com distrofia muscular de Duchenne (DMD) não está relacionada ao uso do Elevidys. O remédio é a única terapia gênica capaz de retardar os efeitos da condição rara e grave, caracterizada pela fraqueza muscular progressiva e degeneração do tecido muscular.
Receba as principais notícias direto no WhatsApp! Inscreva-se no canal do Terra
Corroborando com a declaração da Agência Nacional de Vigilância Sanitária (Anvisa), o parecer da FDA relaciona o óbito a uma "infecção viral grave, intensificada por imunossupressão”. A fatalidade, de acordo com o órgão, apresentou um “nexo causal improvável” com o medicamento.
Com o resultado das investigações, a agência americana recomendou a remoção da suspensão voluntária do medicamento, que custa cerca de R$ 17 milhões, um dos mais caros do mundo. No Brasil, por precaução, a Anvisa também havia suspendido temporariamente a comercialização, distribuição, fabricação, importação, propaganda e uso do Elevidys.
“A decisão foi tomada de forma cientificamente prudente e preventiva, diante do surgimento de novos dados internacionais que apontam para hepatotoxicidade grave com desfecho fatal”, explicou a agência em nota publicada no último dia 25.
O registro do medicamento no País foi concedido à empresa Roche Farma Brasil em dezembro de 2024, em caráter excepcional, apenas para pacientes pediátricos deambuladores (de 4 a 7 anos).
Em nota, a empresa farmacêutica afirmou que, no Brasil, “segue o diálogo com a Anvisa e demais autoridades competentes para garantir que todas as decisões estejam alinhadas com a segurança do paciente e com as diretrizes regulatórias vigentes.”
De acordo com a Anvisa, citando informações da Roche, cerca de dez brasileiros já foram tratados com o medicamento. E, até 25 de julho, a agência só havia recebido três notificações adversas, todos ocorridos em 2025.
"De acordo com a análise de causalidade dos eventos adversos, dois deles foram classificados como prováveis e com evolução favorável e compatível com os efeitos já descritos em bula e observados nos estudos clínicos", pontua a nota, que destaca entre os sintomas o aumento de enzimas musculares (creatina quinase), aumentos das enzimas hepáticas e hepatite, além de sintomas gastrointestinais.
Já o terceiro caso notificado no Brasil apresentou nexo causal improvável com o uso do Elevidys®, sendo o quadro clinicamente compatível com uma infecção viral grave (influeza A), intensificada por imunossupressão, resultando em óbito. "A bula do Elevidys® recomenda adiar a administração em casos de infecção ativa e preconiza a vacinação como mecanismo preventivo", destaca o órgão.
O que é a distrofia muscular de Duchenne?
A distrofia muscular de Duchenne (DMD) é uma doença genética, caracterizada pela degeneração e fraqueza progressivas dos músculos, que controlam os movimentos.
É considerada uma doença rara: de acordo com o Movimento Duchenne, afeta cerca de 1 a cada 5 mil pessoas, o que representa cerca de 20 mil novos casos por ano. No Brasil, a estatística é de pelo menos 300 novos pacientes por ano.
Os meninos são os principais afetados. As meninas, por sua vez, podem carregar o gene defeituoso, mas não apresentam sintomas na maior parte dos casos.


-s4se2df1kkdu.png)