45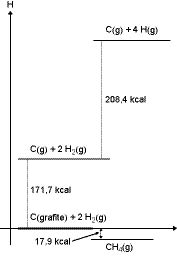
O gráfico mostrado representa as etapas que correspondem à formação do gás metano, um dos componentes do gás natural veicular (GNV). A respeito das informações contidas no gráfico e com base em seus conhecimentos em termoquímica, podemos afirmar que:
a) a transformação do carbono grafite em carbono gasoso é um processo exotérmico, que envolve a liberação de 171,7 kcal/mol de carbono.
b) a decomposição da molécula de hidrogênio é uma reação endotérmica e o valor da energia de ligação H – H é de 208,4 kcal/mol.
c) de acordo com a lei de Hess, a entalpia de formação do metano corresponde a – 17,9 kcal/mol, independentemente de a reação ser elementar ou ocorrer em etapas.
d) a energia liberada na formação do gás metano seria menor se o carbono se encontrasse na forma alotrópica do diamante.
e) a reação de decomposição do metano em seus átomos constituintes envolve a liberação de 17,9 kcal.